Die paroxysmale nächtliche Hämoglobinurie (PNH) ist eine äußerst seltene, nicht erbliche Blutkrankheit, der eine genetische Veränderung einiger Blutstammzellen zugrunde liegt. Infolgedessen können bestimmte Blutzellen eine Gruppe von Eiweißen auf ihrer Oberfläche nicht mehr ausprägen. Dadurch sind diese Zellen anfällig für einen Angriff durch das sogenannte Komplementsystem, das ein Bestandteil des körpereigenen Immunsystems ist. Insbesondere die Zerstörung der roten Blutkörperchen – auch als Hämolyse bezeichnet – ist verantwortlich für eine Vielzahl der Symptome bei der PNH.
Was ist der Auslöser der PNH?
Die PNH ist im Wesentlichen auf Veränderungen (Mutationen) in Blutstammzellen zurückzuführen, genauer gesagt im sogenannten PIG-A-Gen, also einem bestimmten Abschnitt des Erbguts.1
In der Fachsprache ist die Rede von einer somatischen Mutation. Das heißt, sie betrifft nur einzelne Blutstammzellen und kann nicht vererbt werden. Bei Betroffenen der PNH führt die Mutation des PIG-A-Gens dazu, dass die entsprechenden Zellen ein bestimmtes Protein nicht mehr korrekt ausbilden. Dieses Protein wiederum hat im Normalfall eine Schlüsselrolle bei der Neubildung sogenannter GPI-Anker inne.
GPI-Anker sind ein wichtiger Teil vieler Proteine. Verliert eine Zelle die Fähigkeit, GPI-Anker auszubilden, verlieren diese Proteine ihre Funktion. Blutstammzellen weisen mehr als zwölf solcher GPI-verankerten Proteine auf, die im Falle der PIG-A-Mutation bei der PNH funktionslos werden.2,3
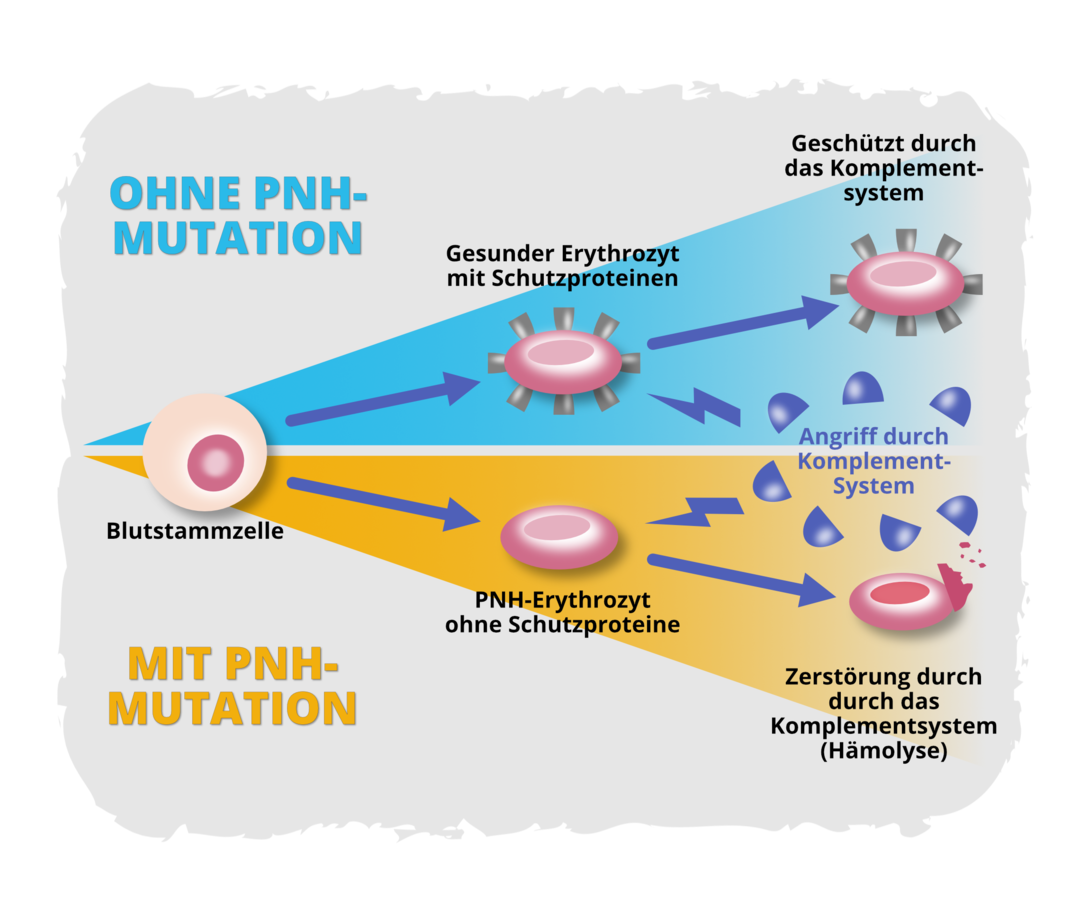
Zwei zu dieser Gruppe gehörende Proteine, CD55 und CD59, spielen eine zentrale Rolle bei der Entstehung der PNH und ihrer typischen Symptome2,4 Diese Proteine befinden sich im Normalfall unter anderem auf der Oberfläche von roten Blutkörperchen (Erythrozyten) und schützen sie vor einem Angriff durch das körpereigene Komplementsystem, einem Teil des Immunsystems. CD55 und CD59 auf der Oberfläche gesunder Erythrozyten dienen somit der Selbsterkennung und sorgen dafür, dass das Komplementsystem nicht irrtümlich die körpereigenen Blutzellen angreift und zerstört.5
Die Erythrozyten entwickeln sich aus Blutstammzellen. Diejenigen roten Blutkörperchen, die wie bei der PNH eine PIG-A-Mutation aufweisen, können die Proteine CD55 und CD59 nicht auf der Zelloberfläche ausbilden. Dadurch ist der Selbsterkennungsmechanismus und der damit verbundene Schutz vor einem Angriff durch das Komplementsystem nicht gegeben: Bestimmte Komponenten des Komplementsystems erkennen die betroffenen Erythrozyten als körperfremd und zerstören sie. Den Abbau der Erythrozyten bezeichnen Fachleute als Hämolyse.3,6
Nicht alle Erythrozyten sind betroffen
Es sind nur diejenigen Erythrozyten betroffen, die den mutierten Blutstammzellen entstammen. Das heißt, im Blut von Menschen mit PNH liegen sowohl gesunde Erythrozyten vor als auch solche, die anfällig für einen Angriff durch das Komplementsystem sind.7,8 Der Anteil an ungeschützten Erythrozyten nimmt dabei mit Fortschreiten der Erkrankung und bei unzureichender Behandlung zu. Die genaue Ursache hierfür ist bislang noch nicht bekannt.9
Der Anteil an defekten PNH-Zellen wird mithilfe der sogenannten PNH-Klongröße angegeben. Da die defekten Erythrozyten abgebaut werden und nicht bestimmt werden können, wird die PNH-Klongröße in der Regel anhand der weißen Blutkörperchen bestimmt. Sie sind zwar auch von der PIG-A-Mutation betroffen, jedoch werden sie nicht durch das Komplementsystem zerstört. Der Anteil der Leukozyten, die den entsprechenden Defekt aufweisen, kann gemessen werden, um Aussagen über die PNH-Klongröße zu treffen.
Ekiva PNH: Ihre smarte Begleitung für das Leben mit PNH
Behalten Sie Ihre PNH-Symptome im Blick und erhalten Sie genau die Unterstützung, die Sie brauchen. Mit dem Symptom-Tracker von Ekiva, der kostenlosen App für PNH-Betroffene, können Sie Ihre individuellen Symptome aufzeichnen und beim nächsten Arztbesuch vorlegen. So lässt sich die Behandlung an Ihre Bedürfnisse anpassen.

Entstehung der PNH
Die PNH kann sich als eigenständige Erkrankung entwickeln (hämolytische oder klassische PNH). Sie kann jedoch auch im Zusammenhang mit einer bereits bestehenden Erkrankung des Knochenmarks auftreten: Die aplastische Anämie begünstigt die zusätzliche (sekundäre) Entstehung einer PNH.
Entwickelt sich die PNH aus einer aplastischen Anämie, sprechen Fachleute vom aplastische Anämie/PNH-Syndrom (AA/PNH-Syndrom). Es unterscheidet sich von der klassischen Form zum Teil in den Symptomen sowie der Prognose.1,10
Das Komplementsystem als Teil des Immunsystems
Das Komplementsystem ist ein zentraler Bestandteil des angeborenen Immunsystems und maßgeblich an der Bekämpfung von Fremdzellen und anderen Eindringlingen wie Bakterien, Viren oder Pilzen in der Blutbahn beteiligt.
Es setzt sich aus mehr als 30 Proteinen zusammen, die teilweise frei im Blut zirkulieren und zum Teil auf der Oberfläche bestimmter Zellen verankert sind.11 Das Komplementsystem kann über verschiedene Wege initiiert werden. Infolgedessen wird eine Kettenreaktion ausgelöst, bei der sich Proteine in einer bestimmten Reihenfolge gegenseitig aktivieren. Letztlich führt die Aktivierung des Komplementsystems zur Zerstörung des Krankheitserregers.12
Die zentrale Vermittlerin in der Kettenreaktion von aufeinanderfolgenden Proteinaktivierungen ist die C3-Konvertase. Sie leitet mehrere Prozesse ein, die zur Bekämpfung der Krankheitserreger beitragen:
- Die Krankheitserreger werden mit bestimmten Proteinen markiert, um weiteren Komponenten des Immunsystems die Erkennung und somit den Angriff zu erleichtern (Opsonierung).
- Entzündungsreaktionen werden eingeleitet, die ebenfalls bei der Bekämpfung der Krankheitserreger unterstützen.
- Der sogenannte Membranangriffskomplex wird gebildet und leitet den Zerfall der eingedrungenen Erreger ein.11,12,13
Das Komplementsystem wird streng reguliert. Das soll verhindern, dass auch gesunde Körperzellen angegriffen und zerstört werden. Bestimmte Mechanismen unterbinden eine übermäßige Aktivierung des Komplementsystems und erlauben es ihm, zwischen körpereigen und körperfremd zu unterscheiden.14
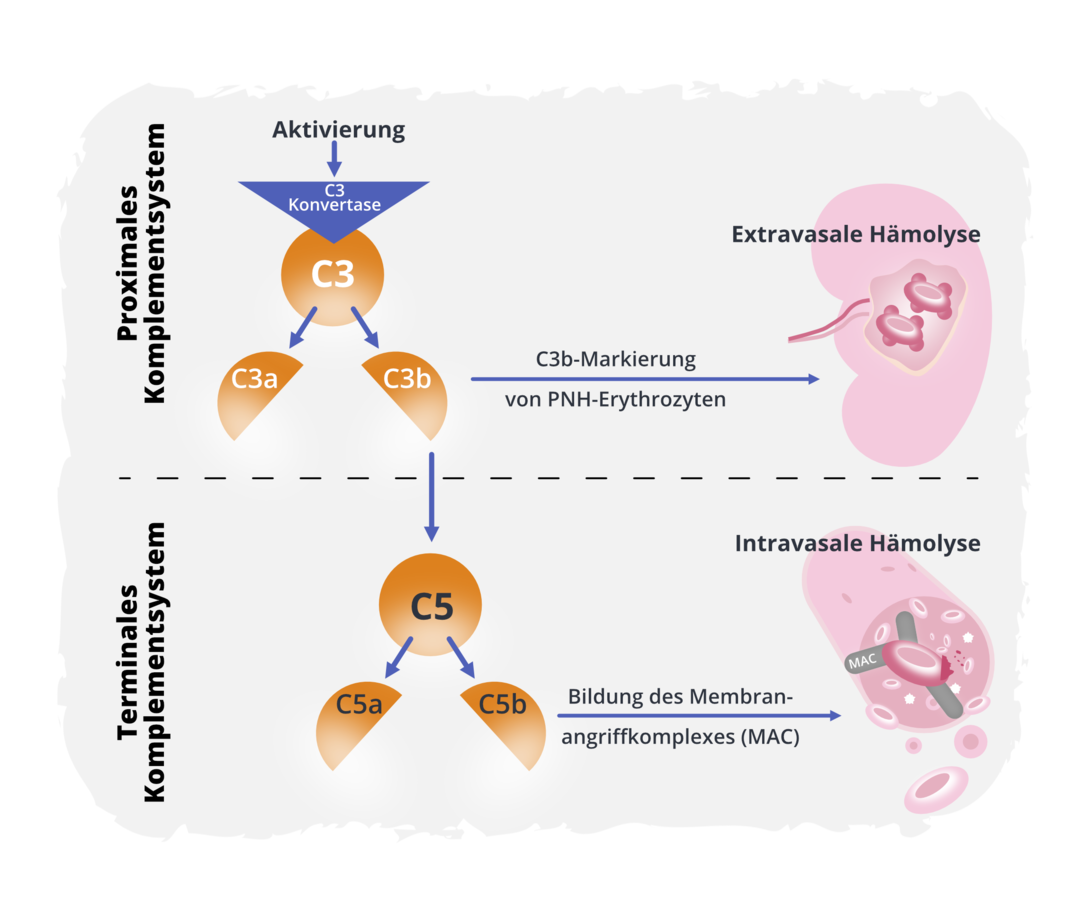
Die Aktivierung des Komplementsystems kann über unterschiedliche Wege erfolgen. Die Folge ist stets die Bildung der sogenannten C3-Konvertase. Die C3-Konvertase spaltet infolgedessen das Protein C3 in die Komponenten C3a und C3b. Während C3a Entzündungsreaktionen vermittelt, hat C3b zwei Funktionen: Es bindet zum einen an die Oberfläche von Fremdstoffen und Krankheitserregern und markiert sie so als körperfremd (Opsonierung), um den Abbau durch Abwehrzellen zu erlauben. Zum anderen ist C3b an der Bildung der C5-Konvertase beteiligt. Die C5-Konvertase wiederum spaltet das Protein C5 in die Fragmente C5a und C5b. Während C5a ähnlich wie C3a Entzündungsreaktionen in Gang setzt, bildet C5b zusammen mit einigen anderen Proteinen den Membranangriffskomplex.
Hämolyse: Der Abbau roter Blutkörperchen
Hämolyse bezeichnet den Abbau beziehungsweise den Zerfall roter Blutkörperchen (Erythrozyten). Ein Großteil der Symptome der PNH ist auf die chronische Hämolyse zurückzuführen.15
Die Hämolyse ist nicht immer krankhaft
Bei der Hämolyse handelt es sich grundlegend um einen normalen physiologischen Prozess, der ständig zu einem gewissen Grad im Körper abläuft. Nach etwa 120 Tagen Lebensdauer werden Erythrozyten vorwiegend in Milz und Leber abgebaut und durch neue rote Blutkörperchen ersetzt, die kontinuierlich im Knochenmark produziert werden.16 Erst wenn Erythrozyten vorzeitig und in erhöhtem Maße abgebaut werden, ist die Hämolyse problematisch.
AdobeStock_148587006_flashmovie
Die Hämolyse findet bei der PNH überwiegend innerhalb der Blutgefäße statt (intravasale Hämolyse). Die intravasale Hämolyse ist vor Therapiebeginn hauptverantwortlich für die Symptome der Erkrankung. In manchen Fällen erfolgt der vorzeitige Abbau der roten Blutkörperchen zusätzlich in Organen wie der Milz und der Leber (extravasale Hämolyse).10 Diese ist zunächst allerdings nicht von klinischer Relevanz.
Kann der Abbau der Erythrozyten nicht mehr durch die Neubildung im Knochenmark ausgeglichen werden, liegt eine hämolytische Anämie (Blutarmut) vor. Durch den Mangel an Erythrozyten gelangt weniger Sauerstoff zu den Organen, was weitreichende körperliche Folgen haben kann. Darüber hinaus werden bestimmte Bestandteile der aufgelösten Erythrozyten ins Blut entlassen, vor allem der rote Blutfarbstoff Hämoglobin. Größere Mengen freien Hämoglobins können verschiedene Komplikationen mit sich bringen.
AdobeStock_315092223_SciePro
Hämolytische Krisen
Eine hämolytische Krise bezeichnet einen akuten Zustand, bei dem es innerhalb kurzer Zeit zu einem stark erhöhten Abbau von Erythrozyten kommt. Eine hämolytische Krise kann mitunter lebensbedrohliche Komplikationen zur Folge haben. Sie wird zumeist durch Faktoren ausgelöst, die das Immunsystem zusätzlich aktivieren – beispielsweise eine Infektion oder Stress.
Oftmals geht eine hämolytische Krise mit schwerwiegenden körperlichen Beschwerden einher, dazu gehören etwa Fieber, Schüttelfrost, Gelbsucht (Ikterus) und Schocksymptome. Letztere zeigen die Sauerstoffunterversorgung des Körpers an und umfassen beispielsweise Blässe, Herzrasen und Zittern.17
Passende Themen zum Weiterlesen:

iStock-1496098113_FreshSplash
Ekiva-App
Behalten Sie Ihre Symptome im Blick und erhalten Sie genau die Unterstützung, die Sie brauchen: mit dem Symptom-Tracker von Ekiva, der kostenlosen App für PNH-Betroffene.

iStock-1450980413_Nes
PNH-Symptome
Symptome wie Müdigkeit, und Blutarmut können auf eine paroxysmale nächtliche Hämoglobinurie (PNH) hinweisen. Mehr zu den verschiedenen Symptomen der PNH.

iStock-884707940_Rostislav_Sedlacek
PNH – Diagnose und Prognose
Die Diagnose der PNH umfasst mehrere Schritte. Dazu gehören eine körperliche Untersuchung und eine genaue Blutuntersuchung. Mehr zur Diagnose und Prognose.
Quellen:
- Schubert J, Bettelheim P, Brümmendorf TH et al. (2023). Paroxysmale nächtliche Hämoglobinurie (PNH). Onkopedia Leitlinie (Stand Juni 2023). https://www.onkopedia.com/de/onkopedia/guidelines/paroxysmale-naechtliche-haemoglobinurie-pnh/@@guideline/html/index.html (letzter Aufruf am 19.01.2024).
- Brodsky RA. (2014). Paroxysmal nocturnal hemoglobinuria. Blood. 124(18): 2804-11. doi: 10.1182/blood-2014-02-522128
- Szlendak U, Budziszewska B, Spychalska J et al. (2022). Paroxysmal nocturnal hemoglobinuria: advances in the understanding of pathophysiology, diagnosis, and treatment. Pol Arch Intern Med. 132: 16271. doi:10.20452/pamw.16271
- Medof ME, Kinoshita T, Nussenzweig V. (1984). Inhibition of complement activation on the surface of cells after incorporation of decay-accelerating factor (DAF) into their membranes. J Exp Med. 160(5): 1558-1578. doi: 10.1084/jem.160.5.1558
- Bektas M, Copley-Merriman C, Khan S et al. (2020). Paroxysmal nocturnal hemoglobinuria: role of the complement system, pathogenesis, and pathophysiology. J Manag Care Spec Pharm. 12: 3-8. doi: 10.18553/jmcp.2020.26.12-b.s3
- Colden MA, Kumar S, Munkhbileg B et al. (2022). Insights Into the Emergence of Paroxysmal Nocturnal Hemoglobinuria. Front Immunol. 12:830172. doi: 10.3389/fimmu.2021.830172
- Oni SB, Osunkoya BO, Luzzatto L. (1970). Paroxysmal nocturnal hemoglobinuria: evidence for monoclonal origin of abnormal red cells. Blood. 36(2): 145-152. PMID: 5448520. doi: 10.1182/blood.V36.2.145.145
- Armstrong C, Schubert J, Ueda E et al. (1992). Affected paroxysmal nocturnal hemoglobinuria T lymphocytes harbor a common defect in assembly of N-acetyl-D-glucosamine inositol phospholipid corresponding to that in class A Thy-1- murine lymphoma mutants. J Biol Chem. 267(35): 25347-25351. doi: 10.1182/blood.V36.2.145.145
- Brodsky RA. (2009). How do PIG-A mutant paroxysmal nocturnal hemoglobinuria stem cells achieve clonal dominance? Expert Review of Hematology. 2(4): 353-356. doi: 10.1586/ehm.09.35
- Hill A, DeZern AE, Kinoshita T et al. (2017). Paroxysmal nocturnal haemoglobinuria. Nature Reviews Disease Primers. 3, 17028. doi: 10.1038/nrdp.2017.28
- Sarma JV, Ward PA. (2011). The complement system. Cell Tissue Res. 343, 227-235. doi: 10.1007/s00441-010-1034-0
- Mathern DR, Heeger PS. (2015). Molecules Great and Small: The Complement System. Clin J Am Soc Nephrol. 10(9): 1636-1650. doi: 10.2215/CJN.06230614
- Morgan BP. (2000). The Complement System: An Overview. Complement Methods and Protocols. 150: 1-13. doi: 10.1385/1-59259-056-X:1
- Ricklin D, Hajishengallis G, Yang K et al. (2010). Complement: a key system for immune surveillance and homeostasis. Nat Immunol. 11(9): 785-797. doi: 10.1038/ni.1923
- Parker CJ. (2016). Update on the diagnosis and management of paroxysmal nocturnal hemoglobinuria. Hematology Am Soc Hematol Educ Program. 2016(1): 208-216. doi: 10.1182/asheducation-2016.1.208
- Amboss. Erythrozyten. https://www.amboss.com/de/wissen/erythrozyten/ (letzter Aufruf am 19.01.2024).
- Amboss. Hämolytische Anämie. https://www.amboss.com/de/wissen/hamolytische-anamie/ (letzter Aufruf am 19.01.2024).

